| |
1.
Corrosie
is de
aantasting van metalen door roestvorming (reageren met zuurstof)
waarbij ook water nodig is. In algemene
termen: corrosie is een ongewenste chemische of elektrochemische aantasting van een
bepaald materiaal uitgaande van het oppervlak. Bijvoorbeeld een metaal staat daarbij elektronen af aan
zuurstof (de oxidator) uit de lucht waarbij als transporteur van
elektronen en ionen water benodigd is. Het metaal zelf ondergaat oxidatie,
waardoor op het metaal dan een laagje metaaloxide of metaalhydroxide ontstaat
("roest").
Metalen en bepaalde stoffen verdragen elkaar niet goed en vormen
corrosie; bekende voorbeelden: rvs
en chloor, zink en gips.
Ook zuren en conserveermiddelen kunnen de corrosie versnellen. Verder dient
bijvoorbeeld staal in een kustgebied (zout milieu tot ca. 10 km uit de kust) beter beschermd te worden dan
wanneer het zich bijvoorbeel op de Veluwe bevindt; een stalen latei bijvoorbeeld
moet in het kustgebied voorzien worden van een 2-laags poedercoating van 120 microgram, daarbuiten volstaat thermisch
verzinkt of een 1-laags poedercoating van 80 microgram.
De corrosieklasse (corrosiebelastingscategorie)
geeft de belasting die vocht en atmosferische omgeving op staal kan
hebben.
Een metaal wordt beschermd tegen corrosie wanneer er een constante aanvoer van
elektronen is. De spanningsreeks
(verdringingsreeks) van de metalen geeft bij oxidatie aan welk
metaal zich zal opofferen ten gunste van een ander metaal. Bijvoorbeeld
kan zink ijzer beschermen tegen roest als het zink "in elektrisch contact wordt gebracht met ijzer, doordat het van zichzelf een lagere potentiaal heeft dan ijzer. Het zink gaat in oplossing en wordt de anode zodat het ijzer van elektronen voorzien wordt en de ionen niet in oplossing zullen gaan. Een coating is werkzamer naarmate deze meer zinkdeeltjes bevat."
Verzinken van ijzer gaat daarmee
corrosie tegen. Zie ook kathodische
bescherming.
Anderzijds kunnen metalen elkaar onderling ook vaak niet verdragen,
waardoor galvanische corrosie ontstaat,
bijvoorbeeld als een plaat aluminium wordt bevestigd met rvs-popnagels.
Methoden om corrosie tegen te gaan:
- coaten
- verzinken
-
kathodisch
beschermen
- toevoegen van andere metalen (legeringen)
- overdimensionering
- vermijden dat water en vuil blijven staan in de constructie en zich kunnen
ophopen.
Spanningscorrosie van rvs treedt op in een chloorhoudend milieu
in combinatie met trekspanningen in het metaal.
Corrosie kan ook glas aantasten, zie bij glascorrosie.
corrosie in een leiding (spirotech):  |
ander duidelijk voorbeeld van corrosie; klik voor groter (foto joostdevree):  |
contactcorrosie of galvanische corrosie treedt op door het spanningsverschil dat ontstaat tussen metalen van verschillende "edelheid" (zie de spanningsreeks); klik voor groter!:  |
vermijden van corrosie bij stalen constructies (vooral: vermijd ophopen van water en vuil, in welke situatie dan ook):  |
vermijden corrosie bij profielen bij buitenspouwbladen: 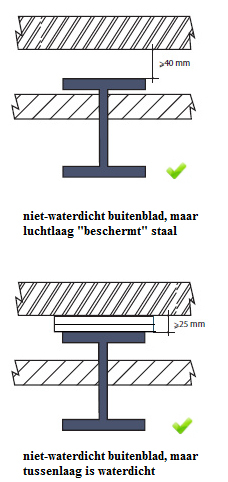 |
| spanningsreeks
van metalen (verdringingsreeks, galvanische reeks), gaande van onedel naar
edel 1): Li - Cs - K - Ba - Ca - Na - Mg - Be - Al - Mn - Zn - Cr - Fe - Cd - Co - Ni - Sn - Pb - H - Cu - Ag - Hg - Pt -Au 2) |
| metaal of legering | voltage | onedel, halfedel, edel |
| 3) | 4) | |
| Li (lithium) | -3,0 | onedel |
| Cs (cesium) | -2,9 | |
| K (kalium) | -2,9 | |
| Ba (barium) | -2,9 | |
| Ca (calcium) | -2,8 | |
| Na (natrium) | -2,7 | |
| Mg (magnesium) | -2,4 | |
| magnesium legeringen | ||
| Be (berylium) | -1,7 | |
| Al (aluminium) | -1,7 | |
| gegalvaniseerd ijzer |
||
| Mn (mangaan) | -1,1 | |
| Zn (zink) | -0,75 | |
| gietijzer | -0,7? | |
| Cr (chroom) | -0,55 | |
| verchroomd staal | -0,5? | |
| Fe (ijzer) of staal |
-0,45 | |
| Cd (cadmium) | -0,4 | |
| Co (kobalt) | -0,3 | |
| Ni (nikkel, actief) | -0,25 | |
| inconel (actief) | -0,2 | |
| chroomstaal (actief) | ||
| RVS 304 (actief) | ||
| RVS 316 (actief) | ||
| lood-tin-soldeer | ||
| Sn (tin) | -0,15 | |
| Pb (lood) | -0,1 | |
| vernikkeld | -0,15 | |
| H | 0 5) | |
| messing | halfedel | |
| brons | ||
| koper-nikkel legeringen | ||
| monel (nikkel-koper) | -0,15? | |
| zilversoldeer | ||
| nikkel (gepassiveerd) | ||
| inconel (gepassiveerd) | -0,1 | |
| chroomstaal (gepassiveerd) | ||
| RVS 304 (gepassiveerd) | -0,1? | |
| RVS 316 (gepassiveerd) | -0,1? | |
| Sb (antimoon) | +0,1 | |
| Cu (koper) | +0,4 | |
| Hg (kwik) | +0,8 | |
| Ag (zilver) | +0,8 | |
| grafiet | ||
| Pt (platina) | +0,9 | edel |
| Au (goud) | +1,4 |
1) Omdat de waarden hiervan per bron nogal
verschillen, waarschijnlijk door de manier van bepalen (in zoute
oplossing e.d.), is
steeds een ongeveer-waarde aangegeven. Zie o.m. spanningsreeks
sort op naam en spanningsreeks
sort op voltage.
Ook legeringen zijn hier
opgenomen omdat die in de bouw vaak voorkomen.
2) Ezelsbruggetje voor de meest gebruikte metalen (er zijn
nog diverse variaties):
Kleine Carla Nagel Mag Alleen
op Zondagen en Christelijke Feestdagen
Niet Snoepen Probeer Haar te Cussen
Hoog Agterin een Platina Auto.
3) Gepassiveerd (of passief) wil zeggen dat het metaal of
de legering door een oxidehuid beter beschemd is tegen corrosie (zie
bij passiveren). Een
niet-gepassiveerd metaal of legering wordt actief genoemd.
4) "In de spanningsreeks worden de metalen die links staan van waterstof (dus van Li tot Pb) en die dus relatief gemakkelijk oxideren, onedele metalen genoemd.
Cu, Ag en Hg zijn halfedele metalen en Pt en Au zijn edele metalen."
5) Waterstof is de referentie-elektrode (platinaplaatje in
contact met H2-gas en H+-ionen): per definitie wordt hieraan E= 0 Volt
toegekend.
Documentatie
- Corrosie
maakt meer kaport dan je denkt
Afbeeldingen o.m. Spirotech.
Zie Corrosiehelpdesk,
AluRvs, betonrot
(corrosie van wapeningsstaal), corrosiebescherming
van stalen damwanden, cortenstaal, walshuid.
Verg. erosie
("erosiecorrosie").
![]() Eng. corrosion
Eng. corrosion
2.
Corrosie van de wapening van beton is een andere term voor wat vaak
"betonrot" wordt genoemd.